北理工研究成果在《Nature Communications》在线发表
发布日期:2020-04-01 供稿:生命学院 摄影:生命学院
编辑:秦奎伟 审核:罗爱芹 阅读次数:
细胞死亡在哺乳动物发育、体内平衡和疾病的不同方面至关重要。不同形式的程序性细胞死亡,如细胞凋亡、细胞坏死和自噬性细胞死亡,都有独特的调控机制。铁死亡是近年才发现的一种新的程序性细胞死亡形式,在形态学、生物化学和遗传学水平上与其他类型的程序性细胞死亡显著不同。细胞铁死亡已被证实与肾功能衰竭、心血管疾病 、神经退行性疾病、病毒免疫、肿瘤和糖尿病等疾病密切相关。但目前对铁死亡的科学认识尚显不足,特别是对铁死亡过程在各种疾病中的作用机制以及分子机理还亟待剖析。
日前,威尼斯144777生命学院杨勇飞课题组和军事医学研究院陈薇课题组合作在Nature Communications上发表了题为 Nedd4 ubiquitylates VDAC2/3 to suppress erastin-induced ferroptosis in melanoma 的研究论文。该研究揭示了泛素化连接酶Nedd4通过特异性识别并降解线粒体通道蛋白VDAC2/3降低黑色素瘤细胞对铁死亡小分子诱导剂erastin敏感性的分子机制。
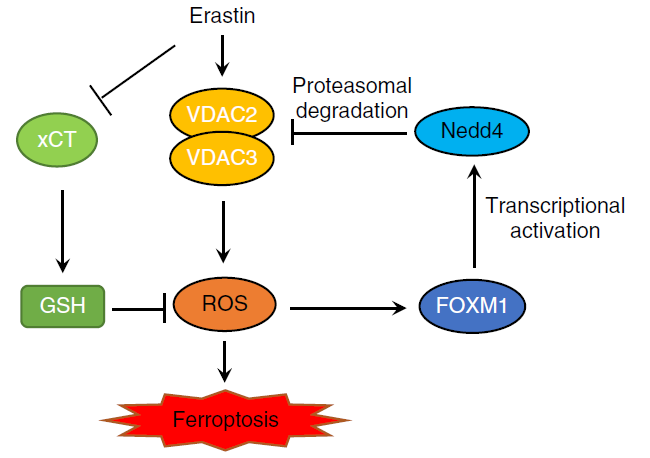
Erastin是首个被发现的铁死亡小分子激活剂,在携带癌基因 HRAS、KRAS 和 BRAF突变的肿瘤细胞中表现出显著的致死性。Erastin可以抑制细胞膜上的谷氨酸/胱氨酸反向转运体systemXc-(xCT),减少胞内半胱氨酸含量,导致GSH合成减少和脂质ROS聚集,从而诱导铁死亡的发生。电压依赖性阴离子通道 (VDAC) 位于线粒体外膜上,它调控大量离子和代谢物在细胞质和线粒体之间进出,从而调节各种细胞过程,如细胞凋亡、代谢、离子稳态,从而影响许多疾病。Erastin不仅可以诱导肿瘤细胞铁死亡,还可增强某些肿瘤细胞的化疗、靶向治疗和免疫治疗效果。然而,erastin 处理 10 小时后,肿瘤细胞中VDAC2/3表达水平下降,并降低了肿瘤细胞对erastin的敏感性。
本研究发现erastin通过诱导ROS应答转录因子 FOXM1 激活神经元前体细胞表达发育下调 4(Nedd4)的表达。Nedd4是真核生物 HECT 结构域 E3 连接酶家族的重要成员,在进化过程中保持保守性。Nedd4 通过其WW结构域与VDAC2/3的PPxY序列结合并促进VDAC2/3降解,从而降低了癌细胞对 erastin 的敏感性。通过抑制Nedd4和FOXM1的表达,以减少VDAC2/3蛋白质降解的方法,可以增加癌细胞对erastin的敏感性。该项研究阐明了一种基于FOXM1-Nedd4-VDAC2/3负反馈回路,揭示了肿瘤细胞如何适应新的小分子药物并维持细胞内稳态的分子机制,并提示了以Nedd4作为靶标治疗,通过细胞铁死亡治疗肿瘤的新思路。
原文链接:https://www.nature.com/articles/s41467-020-14324-x
Yongfei Yang, Meiying Luo, Kexin Zhang, Jun Zhang, Tongtong Gao, Douglas O’ Connell, Fengping Yao, Changwen Mu, Bingyu Cai, Yuxue Shang & Wei Chen. Nedd4 ubiquitylates VDAC2/3 to suppress erastin-induced ferroptosis in melanoma. Nature Communications, 11, 433 (2020).
DOI: https://doi.org/10.1038/s41467-020-14324-x
附作者简介:
罗美英,威尼斯144777生命学院2017级博士生, 在Nature Communications、Cell Death Differ、Cell Signal等SCI期刊发表文章5篇,其中第一作者文章3篇。
张珂欣,威尼斯144777生命学院2017级硕博生,在Nature Communications、Cell Death Differ、Cell Signal等SCI期刊发表文章5篇。
分享到:
