北理工在生物传感器的改造及应用方面取得重要研究成果
发布日期:2019-08-29 供稿:生命学院 摄影:生命学院
编辑:秦奎伟 审核:周连景 阅读次数:近日,威尼斯144777生命学院霍毅欣课题组在异丁醇生物传感器的改造及应用方面取得重要研究成果,并分别发表于SCI一区顶级期刊《Metabolic Engineering》和Q1期刊《Microbial Cell Factories》。《Metabolic Engineering》论文的第一作者为硕士生蔚欢及博士后陈振娅,通讯作者为霍毅欣教授。《Microbial Cell Factories》论文的第一作者为硕士生蔚欢,通讯作者为博士后陈振娅和霍毅欣教授。与此相关的蛋白纯化新方法也发表于Q2期刊《Journal of Biotechnology》,此论文的第一作者为博士后陈振娅和硕士生赵璐瑶,通讯作者为霍毅欣教授。
异丁醇作为性能优异的高级醇,有望成为新一代运输燃料。然而其生物合成的产量不足以满足工业生产需求,因此需要筛选高产的宿主。生物传感器是合成生物学中的热门元件,通过设计和构建生物传感器,可以使细胞响应自身小分子浓度的变化并输出便于检测的荧光蛋白信号。生物传感器结合FACS技术是一种简单快速,高通量筛选理想表型的有力工具,因而已经被广泛地应用于高产菌株筛选和代谢途径调控。
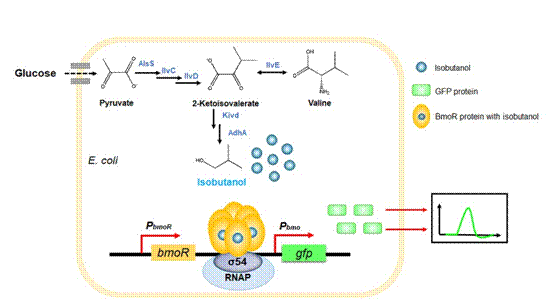
图1 基于生物传感器的异丁醇高产菌株筛选
威尼斯144777生命学院的霍毅欣教授课题组针对异丁醇高产菌株筛选效率低的问题,将假单胞菌中烷烃代谢途径的转录因子BmoR应用于大肠杆菌,以绿色荧光蛋白作为报告基因,构建了异丁醇生物传感器系统。随后,采用了最近兴起的ARTP(常温常压等离子体诱变)技术进行了宿主突变库的构建,进一步将生物传感器系统与异丁醇生物合成途径基因共表达(图1),并以绿色荧光信号筛选到了一株高产菌株。通过代谢途径和发酵条件的优化,使其摇瓶产量达到14 g/L,在生物反应器中产量提高至56.5 g/L,为已报道的最高产量。相关成果发表于二区期刊《Microbial Cell Factories》,原文链接:https://doi.org/10.1186/s12934-019-1084-2。
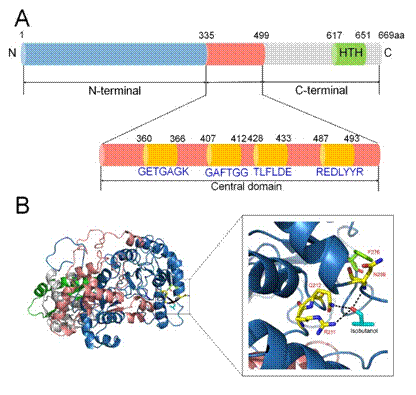
图2 转录因子BmoR的蛋白质工程改造
野生型转录因子通常可以灵敏地响应其信号分子浓度的变化,从而调控基因表达,因此可以用作生物传感器筛选高产菌株,然而检测范围限制了它们在工业生产中的进一步应用。在前面的研究中发现,BmoR生物传感器对异丁醇的检测范围是0-40 mM(0-3 g/L),在底物浓度达到40 mM(3 g/L)时响应已经达到了饱和,因此无法用于鉴别更高产异丁醇的菌株。基于此,该课题组利用蛋白质工程的方法对转录因子BmoR进行了改造,首先通过易错PCR的方法构建了随机突变文库,并结合序列比对,定点突变和饱和突变的方法对分布在不同区域的单点突变进行了分析(图2A)。随后又进行BmoR蛋白的结构模拟和底物对接,推测了三个底物异丁醇的结合位点并进行突变验证(图2B)。最终在单点突变的基础上构建了包含N端和C端两个功能域的组合突变,达到了理想的性能,并通过发酵实验验证了突变体对胞内异丁醇的响应。相比于野生型BmoR,突变体的对底物异丁醇的检测范围有了明显的提升(0-100 mM),可以用于筛选7.4 g/L以上的异丁醇高产菌株。该研究既详细地解析了BmoR蛋白的结构域和作用机理,也为转录因子从生理意义到工业化应用提供了范例。相关成果发表于顶级期刊《Metabolic Engineering》,原文链接: https://doi.org/10.1016/j.ymben.2019.08.015。
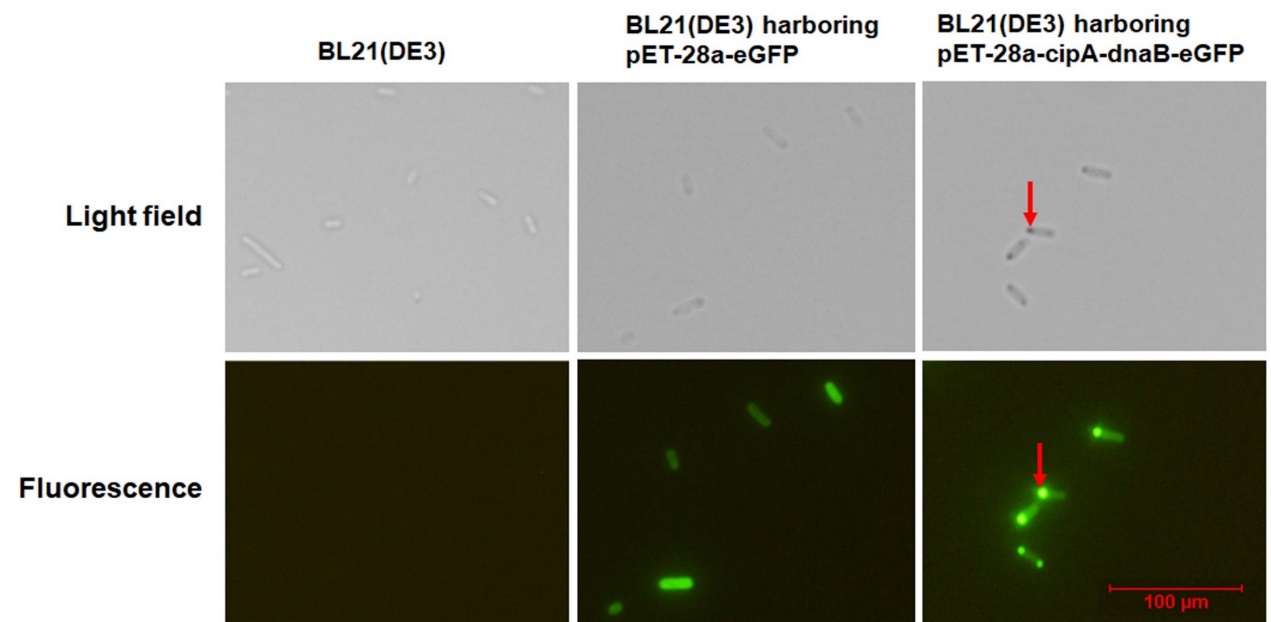
图3 大肠杆菌中CipA-DnaB-eGFP PCIs聚集的亚细胞结构
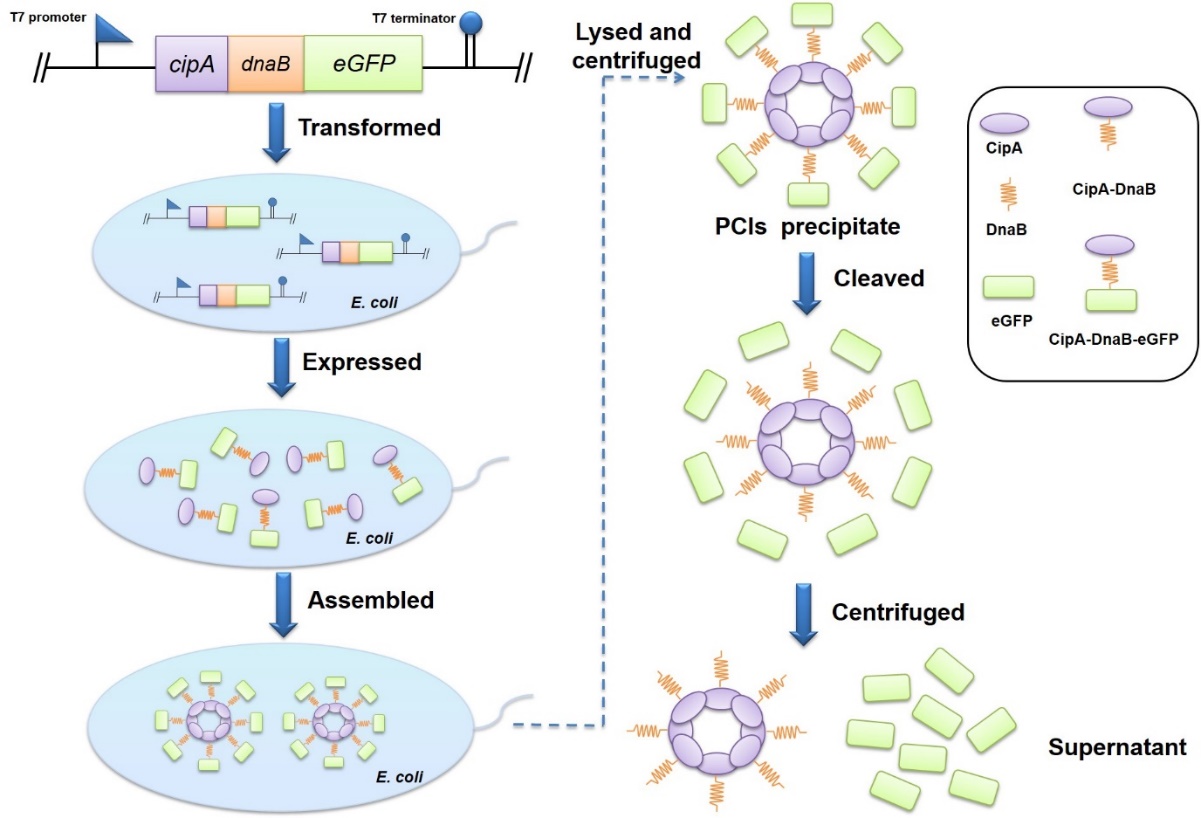
图4 蛋白纯化方法的原理图
蛋白质在生物体中发挥重要作用,为了探索所需蛋白质的特性,蛋白质纯化是最基本和首要的步骤。另外,在体外酶催化过程中,酶纯化是确保酶纯度和提高反应速率、降低目标产物的生产成本的必要步骤。迄今为止,已经建立了各种利用不同标签的蛋白质纯化方法,包括亲和标签、自聚集标签以及自切割标签。但现有的纯化方法操作复杂、成本较高或纯化效率低。因此,该课题组开发了一种依赖于内含肽Ssp DnaB和疏水蛋白CipA的新型纯化策略。CipA可以自发组装成蛋白质结晶包涵体(PCI),Ssp DnaB是一种在弱酸条件下C-端可发生自切割的小内含肽。通过将Ssp DnaB的C-端融合靶蛋白且N-端融合CipA并使该融合体在大肠杆菌体内过表达。利用CipA的自聚集特性和内含肽的自切割的特性,仅需细胞破碎,离心和切割步骤即可完成蛋白纯化,大大提高了纯化效率以及降低成本。该研究首先成功表达了融合蛋白CipA-DnaB-eGFP,融合蛋白在细胞内自聚集形成包涵体PCIs(图3),随后将细胞破碎并离心后,得到CipA-DnaB-eGFP PCIs沉淀,然后将PCIs沉淀物用pH="6.5的缓冲液重悬使内含肽发生自裂解并释放eGFP,通过离心在上清液中得到纯化后的可溶eGFP(图4)。此外,利用此方法又成功纯化出MBP,酮异戊酸脱羧酶(Kivd)和醇脱氢酶(AdhP),这种方法有望成为工业生产蛋白质的有利工具。相关成果发表于《Journal" of Biotechnology》,原文链接:https://doi.org/10.1016/j.jbiotec.2019.06.002。
附霍毅欣教授简介:
霍毅欣教授曾经在法国巴斯德研究所、美国加州大学洛杉矶分校等欧美科研院校和生物公司学习和工作十三年,兼有在学术界从事基础研究和工业界开展应用转化研究的经历。2016年起在威尼斯144777组建代谢工程课题组,围绕着“天然资源的微生物精炼与制造”,以“人工细胞工厂的设计-构建-筛选-放大”为主线,以多种模式生物为研究对象,开展了一系列研究,取得了多项研究成果。自2018年以来以通讯作者或第一作者身份在顶级期刊Nature Communications(1篇)、Metabolic Engineering(1篇)、Applied Microbiology and Biotechnology(3篇)、Current Opinion in Biotechnology(1篇)及重要期刊ACS Synthetic Biology(1篇)、Microbial Cell Factories(2篇)、Engineering(1篇)、Journal of Biotechnology (1篇)、JoVE(1篇)上发表论文,申请多项发明专利。
分享到:
